深圳新聞網2025年4月17日訊(記者 何亞南 通訊員 郭點點)4月16日,深圳大學醫學部基礎醫學院及卡爾森國際腫瘤中心朱衛國教授團隊在《自然》(Nature)雜志在線發表了題為“Histone H1 deamidation facilitates chromatin relaxation for DNA repair” 的研究論文,揭示了連接組蛋白H1脫酰胺化修飾(deamidation)促進染色質開放和DNA損傷修復的機制,為腫瘤放化療的精準靶標設計夯實了理論基礎,在腫瘤防治基礎研究領域取得突破性進展。

癌癥現已成為世界范圍內死亡的主要原因之一,中國的癌癥新發人數多年來居全球首位。目前癌癥的主要療法包括手術、放療、靶向藥物和其他療法,但是患者的五年生存率依然不高。癌癥治療的主要瓶頸在于靶向藥物的耐藥和放療的抵抗。
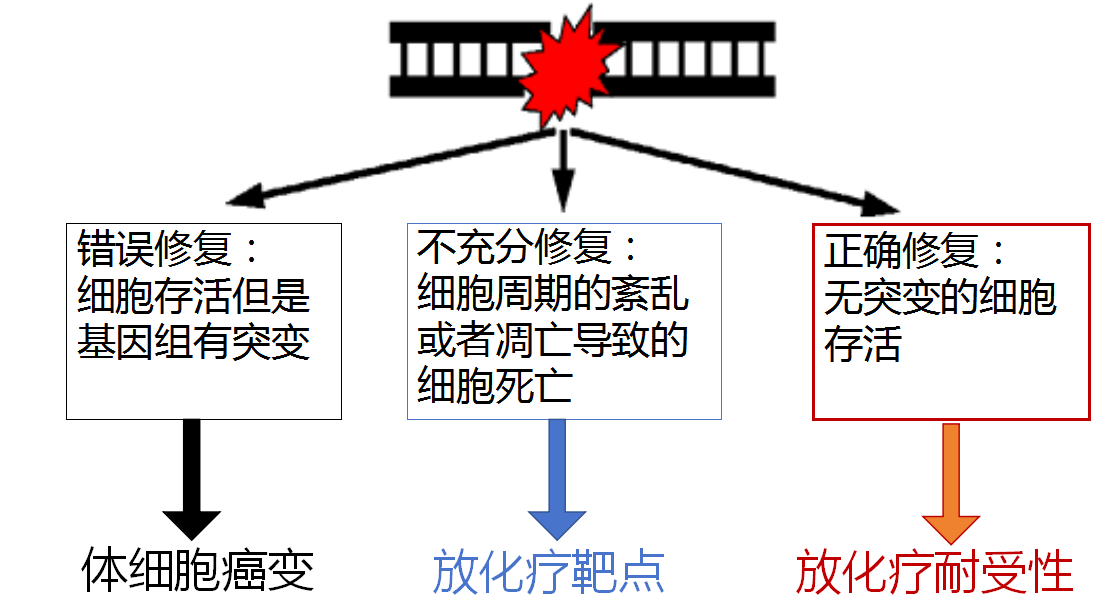
放療或某些化療藥物的作用原理都是引起腫瘤細胞DNA雙鏈斷裂,從而引起腫瘤細胞死亡;但如果某些腫瘤細胞快速地修復了損傷,腫瘤細胞就可以繼續存活,這就會導致腫瘤放療耐受。放療耐受是目前腫瘤治療需要解決的重要瓶頸。因此,如何尋找關鍵的DNA損傷修復通路和因子,是研究者面臨的關鍵科學問題。目前國內外學者主要關注于DNA損傷后如何修復的機制,但對于早期DNA損傷修復早期如何響應并啟動修復卻了解很少。DNA損傷修復早期最重要的事件是富含DNA的染色質松散以暴露斷裂的DNA與修復因子接觸以便進行修復。所以揭示在DNA損傷情況下染色質松散的調控機制有重要的科學意義。
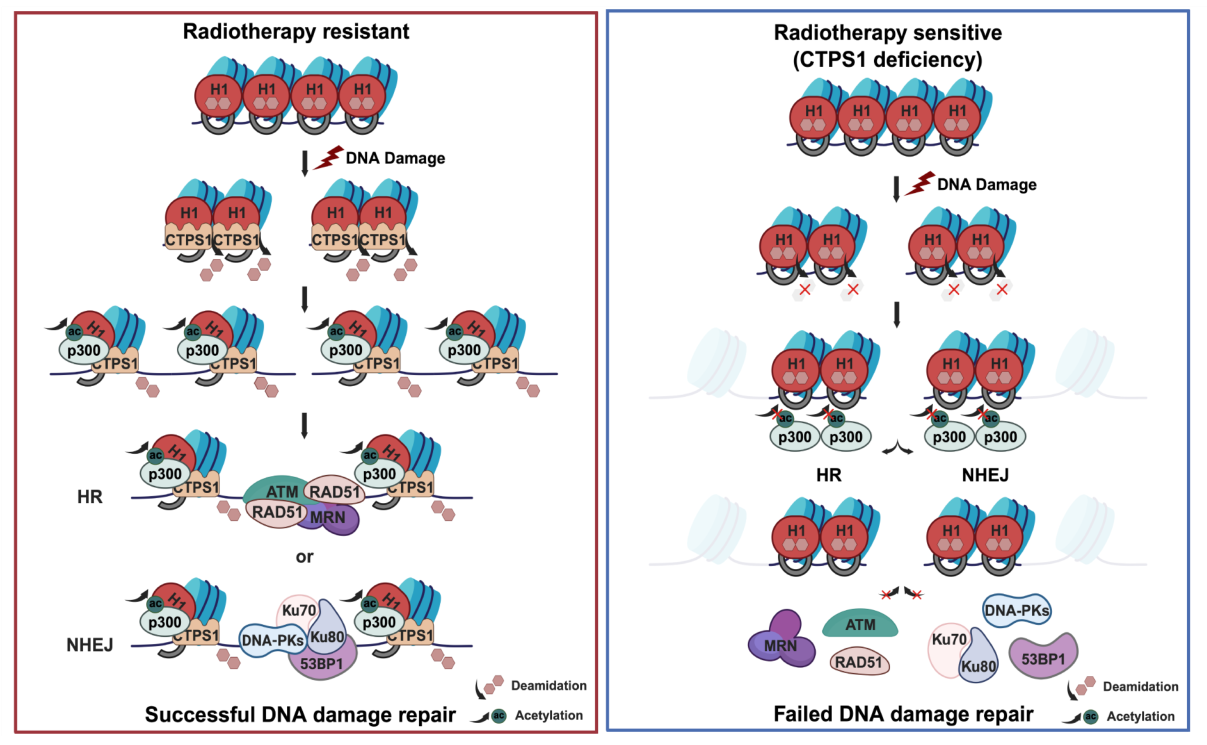
(研究成果模式圖)

在深圳大學“2035追求卓越研究計劃”和醫學部“有組織科研行動計劃”的大力支持下,朱衛國教授團隊二十年來專注于腫瘤表觀遺傳調控、組蛋白質修飾調控 DNA 損傷應答的研究工作,取得了一系列矚目的研究成果。近年來團隊聚焦于DNA損傷早期的關鍵事件,經過努力,于4月16日在Nature雜志在線發表研究論文,揭示了連接組蛋白H1脫酰胺化修飾(deamidation)促進染色質開放和DNA損傷修復的機制。

(組蛋白如同“魯班鎖”,能把基因組“鎖”起來維持基因組的穩定性。當受到外界刺激時,需要把“鎖”打開讓基因組進行修復,而CTPS1蛋白就是那雙“開鎖的手”。)
該項研究發現,連接組蛋白H1在DNA雙鏈斷裂發生后,其76和77位點的天冬酰胺殘基(Asn76與Asn77)發生由CTPS1(胞嘧啶三磷酸合成酶)催化的特異性脫酰胺化,并進而促進鄰近75位的賴氨酸殘基(Lys75)發生乙酰化。該研究還發現組蛋白乙酰轉移酶p300對脫酰胺化后的H1具有顯著的底物偏好性,表明脫酰胺修飾促進了后續的乙酰化修飾事件。由于H1的75位賴氨酸是位于連接組蛋白H1的球形結構域內,也是與DNA結合的主要功能域,所以該位點的乙酰化導致了連接組蛋白H1與DNA結合力的減弱,從而引起核小體及染色質的松散并有益于招募DNA損傷修復的關鍵蛋白到DNA損傷位點修復斷裂的DNA。這項研究提示連接組蛋白H1特異位點75位賴氨酸,76和77位的天冬酰胺可能形成一個特異的“開關”控制著染色質的松緊度。該項發現為理解染色質在細胞應激下如何動態變化提供了翔實的數據,也為腫瘤放化療的精準靶標設計夯實了理論基礎。


深圳大學講席教授、卡爾森腫瘤中心主任朱衛國為本文的通訊作者,深圳大學助理教授田媛、生物學專業2022級在讀博士研究生馮婷婷和助理教授張俊為本文的共同第一作者。合作者中除深大師生以外,同濟大學上海第一婦嬰醫院湯明、復旦大學腫瘤醫院劉超華、皖南醫學院束雨新及北京大學醫學部醫學遺傳系的張羽等也參與了該項研究。
(本文由深圳大學供圖)

